Dari Wikipedia, ensiklopedia bebas
Metode Joback [1] (sering disebut Joback / Reid metode) memprediksi sebelas penting dan umum digunakan sifat termodinamika komponen murni dari struktur molekul saja.
Joback mengasumsikan bahwa tidak ada interaksi antara kelompok dan karenanya hanya menggunakan kontribusi aditif dan tidak ada kontribusi untuk interaksi antara kelompok-kelompok. Metode kontribusi kelompok lainnya, terutama metode seperti UNIFAC , yang memperkirakan sifat campuran seperti koefisien aktivitas, menggunakan kedua parameter kelompok tambahan yang sederhana dan parameter interaksi kelompok. Keuntungan yang besar hanya menggunakan parameter kelompok sederhana adalah sejumlah kecil parameter yang diperlukan. Jumlah parameter yang dibutuhkan interaksi kelompok menjadi sangat tinggi untuk peningkatan jumlah kelompok (1 untuk dua kelompok, 3 untuk tiga kelompok, 6 untuk empat kelompok, 45 untuk sepuluh kelompok dan dua kali lebih banyak jika interaksi tidak simetris.).
Sembilan dari sifat yang satu suhu-independen nilai-nilai, sebagian besar diperkirakan oleh sejumlah sederhana kontribusi kelompok addend ditambah sebuah. Dua dari properti diperkirakan adalah suhu-tergantung: gas ideal kapasitas panas dan dinamika viskositas cairan. Kapasitas panas polinomial menggunakan empat parameter dan persamaan viskositas hanya 2. Dalam kedua kasus parameter persamaan dihitung oleh kontribusi kelompok.
Joback memperluas berbagai sifat didukung, menciptakan parameter baru dan diubah sedikit rumus metode Lydersen tua.
Metode Joback tambahan menggunakan skema kelompok yang sangat sederhana dan mudah untuk menetapkan yang membuat metode dapat digunakan juga untuk orang-orang dengan hanya pengetahuan kimia dasar.
Daftar kelompok tidak mencakup molekul yang umum cukup. Terutama senyawa aromatik yang tidak dibedakan dari cincin yang normal mengandung komponen. Ini adalah masalah berat karena aromatik dan alifatik komponen berbeda sangat.
Data-data dasar dan Reid Joback digunakan untuk memperoleh parameter kelompok agak kecil dan tertutup hanya sejumlah terbatas molekul yang berbeda. Cakupan terbaik telah dicapai untuk titik didih normal (438 komponen) dan yang terburuk untuk panas fusi (155 komponen). Perkembangan saat ini yang dapat menggunakan bank data seperti Bank Data Dortmund atau DIPPR data base memiliki cakupan yang lebih luas.
Formula yang digunakan untuk prediksi titik didih normal menunjukkan masalah lain. Joback diasumsikan konstan kontribusi kelompok ditambahkan dalam seri homolog seperti alkana . Ini tidak menggambarkan perilaku nyata dari titik didih normal dengan benar [5] . Alih-alih konstan kontribusi penurunan dari kontribusi dengan meningkatnya jumlah kelompok harus diterapkan. Rumus yang dipilih dari metode Joback mengarah ke penyimpangan tinggi untuk molekul besar dan kecil dan estimasi yang baik diterima hanya untuk menengah komponen.
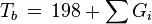

![T_c \, = \, T_b \ left [0,584 + 0,965 \ sum {G_i} - \ left (\ sum {G_i} \ right) ^ 2 \ right] ^ {-1}](http://upload.wikimedia.org/wikipedia/en/math/5/e/2/5e27aeda09899e8e7164087153192bc0.png)
Persamaan temperatur kritis membutuhkan huruf b yang normal T mendidih. Jika nilai eksperimental tersedia dianjurkan untuk menggunakan titik didih. Hal ini, di sisi lain, juga memungkinkan untuk input titik didih normal diperkirakan dengan metode Joback. Hal ini akan menyebabkan kesalahan yang lebih tinggi.
![P_c \, = \, \ left [{0,113 + 0,0032 * N_A - \ sum {G_i}} \ right] ^ {-2}](http://upload.wikimedia.org/wikipedia/en/math/f/5/7/f57e5b452cb356bab7fd243097716193.png)
N J: Jumlah atom dalam struktur molekul (termasuk hidrogen).
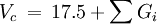


![C_P \, = \, \ sum a_i - 37,93 + \ left [\ jumlah b_i + 0,210 \ right] T + \ left [\ jumlah c_i - 3,91 \ cdot 10 ^ {-4} \ right] T ^ 2 + \ left [\ jumlah d_i + 2.06 \ cdot 10 ^ {-7} \ right] T ^ 3](http://upload.wikimedia.org/wikipedia/en/math/2/1/8/21888753df142af0100db9faa860d4a8.png)
Metode Joback menggunakan polinomial parameter empat untuk menggambarkan ketergantungan suhu kapasitas panas gas ideal. Parameter-parameter ini berlaku dari 273 K ke approx. 1000 K.


![\ Eta_L \, = \, e ^ {M_w \ left [\ sum \ eta_a - 597,82 \ right] / T + \ sum \ eta_b - 11,202}](http://upload.wikimedia.org/wikipedia/en/math/f/b/5/fb5393f9deb15f4b6329bc7d9fea8fa3.png)
M w: Berat Molekul
Metode ini menggunakan dua parameter persamaan untuk menggambarkan ketergantungan suhu dari viskositas dinamis. Para penulis menyatakan bahwa parameter berlaku dari suhu mencair hingga 0,7 dari temperatur kritis (T r <0,7).
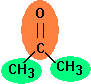
Aseton (propanon) adalah yang paling sederhana keton dan dipisahkan menjadi tiga kelompok dalam metode Joback: dua kelompok metil (-CH3) dan satu kelompok keton (C = O). Karena gugus metil hadir dua kali, kontribusi yang harus ditambahkan dua kali.
Prinsip Dasar
Kelompok Metode Kontribusi
Metode Joback adalah metode kontribusi kelompok . Jenis metode ini menggunakan informasi struktur dasar molekul kimia seperti daftar kelompok fungsional sederhana, menambahkan parameter ke kelompok-kelompok fungsional, dan menghitung sifat thermophysical dan transportasi sebagai fungsi dari jumlah parameter kelompok.Joback mengasumsikan bahwa tidak ada interaksi antara kelompok dan karenanya hanya menggunakan kontribusi aditif dan tidak ada kontribusi untuk interaksi antara kelompok-kelompok. Metode kontribusi kelompok lainnya, terutama metode seperti UNIFAC , yang memperkirakan sifat campuran seperti koefisien aktivitas, menggunakan kedua parameter kelompok tambahan yang sederhana dan parameter interaksi kelompok. Keuntungan yang besar hanya menggunakan parameter kelompok sederhana adalah sejumlah kecil parameter yang diperlukan. Jumlah parameter yang dibutuhkan interaksi kelompok menjadi sangat tinggi untuk peningkatan jumlah kelompok (1 untuk dua kelompok, 3 untuk tiga kelompok, 6 untuk empat kelompok, 45 untuk sepuluh kelompok dan dua kali lebih banyak jika interaksi tidak simetris.).
Sembilan dari sifat yang satu suhu-independen nilai-nilai, sebagian besar diperkirakan oleh sejumlah sederhana kontribusi kelompok addend ditambah sebuah. Dua dari properti diperkirakan adalah suhu-tergantung: gas ideal kapasitas panas dan dinamika viskositas cairan. Kapasitas panas polinomial menggunakan empat parameter dan persamaan viskositas hanya 2. Dalam kedua kasus parameter persamaan dihitung oleh kontribusi kelompok.
Sejarah
Metode Joback merupakan perpanjangan dari metode Lydersen [2] dan menggunakan kelompok-kelompok yang sangat mirip, formula, dan parameter untuk tiga properti Lydersen sudah didukung ( suhu kritis , tekanan kritis , volume kritis).Joback memperluas berbagai sifat didukung, menciptakan parameter baru dan diubah sedikit rumus metode Lydersen tua.
Kekuatan dan Kelemahan Model
Kekuatan
Popularitas dan keberhasilan metode Joback terutama berasal dari daftar grup tunggal untuk semua properti. Hal ini memungkinkan untuk mendapatkan semua sebelas properti didukung dari analisis tunggal dari struktur molekul.Metode Joback tambahan menggunakan skema kelompok yang sangat sederhana dan mudah untuk menetapkan yang membuat metode dapat digunakan juga untuk orang-orang dengan hanya pengetahuan kimia dasar.
Kelemahan
Perkembangan baru dari metode estimasi [3] [4] telah menunjukkan bahwa kualitas dari metode Joback terbatas. Para penulis asli sudah dinyatakan sendiri dalam kertas asli: "akurasi tinggi tidak diklaim, tetapi metode yang diusulkan adalah sering sebagai atau lebih akurat daripada teknik yang digunakan umum sekarang ini.".Daftar kelompok tidak mencakup molekul yang umum cukup. Terutama senyawa aromatik yang tidak dibedakan dari cincin yang normal mengandung komponen. Ini adalah masalah berat karena aromatik dan alifatik komponen berbeda sangat.
Data-data dasar dan Reid Joback digunakan untuk memperoleh parameter kelompok agak kecil dan tertutup hanya sejumlah terbatas molekul yang berbeda. Cakupan terbaik telah dicapai untuk titik didih normal (438 komponen) dan yang terburuk untuk panas fusi (155 komponen). Perkembangan saat ini yang dapat menggunakan bank data seperti Bank Data Dortmund atau DIPPR data base memiliki cakupan yang lebih luas.
Formula yang digunakan untuk prediksi titik didih normal menunjukkan masalah lain. Joback diasumsikan konstan kontribusi kelompok ditambahkan dalam seri homolog seperti alkana . Ini tidak menggambarkan perilaku nyata dari titik didih normal dengan benar [5] . Alih-alih konstan kontribusi penurunan dari kontribusi dengan meningkatnya jumlah kelompok harus diterapkan. Rumus yang dipilih dari metode Joback mengarah ke penyimpangan tinggi untuk molekul besar dan kecil dan estimasi yang baik diterima hanya untuk menengah komponen.
Rumus
Dalam G rumus berikut saya menunjukkan kontribusi kelompok. G i dihitung untuk setiap kelompok tersedia tunggal. Jika sebuah kelompok hadir beberapa kali setiap kejadian dihitung secara terpisah.Titik didih normal
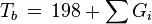
Titik lebur

Suhu Kritis
![T_c \, = \, T_b \ left [0,584 + 0,965 \ sum {G_i} - \ left (\ sum {G_i} \ right) ^ 2 \ right] ^ {-1}](http://upload.wikimedia.org/wikipedia/en/math/5/e/2/5e27aeda09899e8e7164087153192bc0.png)
Persamaan temperatur kritis membutuhkan huruf b yang normal T mendidih. Jika nilai eksperimental tersedia dianjurkan untuk menggunakan titik didih. Hal ini, di sisi lain, juga memungkinkan untuk input titik didih normal diperkirakan dengan metode Joback. Hal ini akan menyebabkan kesalahan yang lebih tinggi.
Tekanan Kritis
![P_c \, = \, \ left [{0,113 + 0,0032 * N_A - \ sum {G_i}} \ right] ^ {-2}](http://upload.wikimedia.org/wikipedia/en/math/f/5/7/f57e5b452cb356bab7fd243097716193.png)
N J: Jumlah atom dalam struktur molekul (termasuk hidrogen).
Volume Kritis
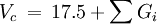
Panas Formasi (Gas Ideal, 298 K)

Energi Gibbs Formasi (Gas Ideal, 298 K)

Kapasitas Panas (Gas Ideal)
![C_P \, = \, \ sum a_i - 37,93 + \ left [\ jumlah b_i + 0,210 \ right] T + \ left [\ jumlah c_i - 3,91 \ cdot 10 ^ {-4} \ right] T ^ 2 + \ left [\ jumlah d_i + 2.06 \ cdot 10 ^ {-7} \ right] T ^ 3](http://upload.wikimedia.org/wikipedia/en/math/2/1/8/21888753df142af0100db9faa860d4a8.png)
Metode Joback menggunakan polinomial parameter empat untuk menggambarkan ketergantungan suhu kapasitas panas gas ideal. Parameter-parameter ini berlaku dari 273 K ke approx. 1000 K.
Panas Penguapan pada Titik didih normal

Panas Fusion

Viskositas Dinamis Cair
![\ Eta_L \, = \, e ^ {M_w \ left [\ sum \ eta_a - 597,82 \ right] / T + \ sum \ eta_b - 11,202}](http://upload.wikimedia.org/wikipedia/en/math/f/b/5/fb5393f9deb15f4b6329bc7d9fea8fa3.png)
M w: Berat Molekul
Metode ini menggunakan dua parameter persamaan untuk menggambarkan ketergantungan suhu dari viskositas dinamis. Para penulis menyatakan bahwa parameter berlaku dari suhu mencair hingga 0,7 dari temperatur kritis (T r <0,7).
Kontribusi Grup
| Kelompok | T c | P c | V c | T b | T m | H bentuk | G bentuk | suatu | b | c | d | H fusi | H VAP | suatu | b |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Negara Kritis data | Suhu dari Transisi Tahap | Kimia kalori Properti | Kapasitas Panas Gas Ideal | Entalpi dari Transisi Tahap | Viskositas Dinamis | ||||||||||
| Non-cincin kelompok | |||||||||||||||
| -CH3 | 0.0141 | -0.0012 | 65 | 23.58 | -5.10 | -76.45 | -43.96 | 1.95E +1 | -8.08E-3 | 1.53E-4 | -9.67E-8 | 0.908 | 2.373 | 548.29 | -1.719 |
| -CH2- | 0.0189 | 0.0000 | 56 | 22.88 | 11.27 | -20.64 | 8.42 | -9.09E-1 | 9.50E-2 | -5.44E-5 | 1.19E-8 | 2.590 | 2.226 | 94.16 | -0.199 |
| > CH- | 0.0164 | 0.0020 | 41 | 21.74 | 12.64 | 29.89 | 58.36 | -2.30E +1 | 2.04E-1 | -2.65E-4 | 1.20E-7 | 0.749 | 1.691 | -322.15 | 1.187 |
| > C < | 0.0067 | 0.0043 | 27 | 18.25 | 46.43 | 82.23 | 116.02 | -6.62E +1 | 4.27E-1 | -6.41E-4 | 3.01E-7 | -1.460 | 0.636 | -573.56 | 2.307 |
| = CH2 | 0.0113 | -0.0028 | 56 | 18.18 | -4.32 | -9.630 | 3.77 | 2.36E +1 | -3.81E-2 | 1.72E-4 | -1.03E-7 | -0.473 | 1.724 | 495.01 | -1.539 |
| = CH- | 0.0129 | -0.0006 | 46 | 24.96 | 8.73 | 37.97 | 48.53 | -8.00 | 1.05E-1 | -9.63E-5 | 3.56E-8 | 2.691 | 2.205 | 82.28 | -0.242 |
| = C < | 0.0117 | 0.0011 | 38 | 24.14 | 11.14 | 83.99 | 92.36 | -2.81E +1 | 2.08E-1 | -3.06E-4 | 1.46E-7 | 3.063 | 2.138 | n. a. | n. a. |
| = C = | 0.0026 | 0.0028 | 36 | 26.15 | 17.78 | 142.14 | 136.70 | 2.74E +1 | -5.57E-2 | 1.01E-4 | -5.02E-8 | 4.720 | 2.661 | n. a. | n. a. |
| ≡ CH | 0.0027 | -0.0008 | 46 | 9.20 | -11.18 | 79.30 | 77.71 | 2.45E +1 | -2.71E-2 | 1.11E-4 | -6.78E-8 | 2.322 | 1.155 | n. a. | n. a. |
| ≡ C- | 0.0020 | 0.0016 | 37 | 27.38 | 64.32 | 115.51 | 109.82 | 7.87 | 2.01E-2 | -8.33E-6 | 1.39E-9 | 4.151 | 3.302 | n. a. | n. a. |
| Cincin kelompok | |||||||||||||||
| -CH2- | 0.0100 | 0.0025 | 48 | 27.15 | 7.75 | -26.80 | -3.68 | -6.03 | 8.54E-2 | -8.00E-6 | -1.80E-8 | 0.490 | 2.398 | 307.53 | -0.798 |
| > CH- | 0.0122 | 0.0004 | 38 | 21.78 | 19.88 | 8.67 | 40.99 | -2.05E +1 | 1.62E-1 | -1.60E-4 | 6.24E-8 | 3.243 | 1.942 | -394.29 | 1.251 |
| > C < | 0.0042 | 0.0061 | 27 | 21.32 | 60.15 | 79.72 | 87.88 | -9.09E +1 | 5.57E-1 | -9.00E-4 | 4.69E-7 | -1.373 | 0.644 | n. a. | n. a. |
| = CH- | 0.0082 | 0.0011 | 41 | 26.73 | 8.13 | 2.09 | 11.30 | -2.14 | 5.74E-2 | -1.64E-6 | -1.59E-8 | 1.101 | 2.544 | 259.65 | -0.702 |
| = C < | 0.0143 | 0.0008 | 32 | 31.01 | 37.02 | 46.43 | 54.05 | -8.25 | 1.01E-1 | -1.42E-4 | 6.78E-8 | 2.394 | 3.059 | -245.74 | 0.912 |
| Halogen kelompok | |||||||||||||||
| -F | 0.0111 | -0.0057 | 27 | -0.03 | -15.78 | -251.92 | -247.19 | 2.65E +1 | -9.13E-2 | 1.91E-4 | -1.03E-7 | 1.398 | -0.670 | n. a. | n. a. |
| -Cl | 0.0105 | -0.0049 | 58 | 38.13 | 13.55 | -71.55 | -64.31 | 3.33e +1 | -9.63E-2 | 1.87E-4 | -9.96E-8 | 2.515 | 4.532 | 625.45 | -1.814 |
| -Br | 0.0133 | 0.0057 | 71 | 66.86 | 43.43 | -29.48 | -38.06 | 2.86E +1 | -6.49E-2 | 1.36E-4 | -7.45E-8 | 3.603 | 6.582 | 738.91 | -2.038 |
| -Aku | 0.0068 | -0.0034 | 97 | 93.84 | 41.69 | 21.06 | 5.74 | 3.21E +1 | -6.41E-2 | 1.26E-4 | -6.87E-8 | 2.724 | 9.520 | 809.55 | -2.224 |
| Oksigen kelompok | |||||||||||||||
| -OH (alkohol) | 0.0741 | 0.0112 | 28 | 92.88 | 44.45 | -208.04 | -189.20 | 2.57E +1 | -6.91E-2 | 1.77E-4 | -9.88E-8 | 2.406 | 16.826 | 2173.72 | -5.057 |
| -OH (fenol) | 0.0240 | 0.0184 | -25 | 76.34 | 82.83 | -221.65 | -197.37 | -2.81 | 1.11E-1 | -1.16E-4 | 4.94E-8 | 4.490 | 12.499 | 3018.17 | -7.314 |
| -O-(nonring) | 0.0168 | 0.0015 | 18 | 22.42 | 22.23 | -132.22 | -105.00 | 2.55E +1 | -6.32E-2 | 1.11E-4 | -5.48E-8 | 1.188 | 2.410 | 122.09 | -0.386 |
| -O-(cincin) | 0.0098 | 0.0048 | 13 | 31.22 | 23.05 | -138.16 | -98.22 | 1.22E +1 | -1.26E-2 | 6.03E-5 | -3.86E-8 | 5.879 | 4.682 | 440.24 | -0.953 |
| > C = O (nonring) | 0.0380 | 0.0031 | 62 | 76.75 | 61.20 | -133.22 | -120.50 | 6.45 | 6.70E-2 | -3.57E-5 | 2.86E-9 | 4.189 | 8.972 | 340.35 | -0.350 |
| > C = O (cincin) | 0.0284 | 0.0028 | 55 | 94.97 | 75.97 | -164.50 | -126.27 | 3.04E +1 | -8.29E-2 | 2.36E-4 | -1.31E-7 | 0. | 6.645 | n. a. | n. a. |
| O = CH-(aldehida) | 0.0379 | 0.0030 | 82 | 72.24 | 36.90 | -162.03 | -143.48 | 3.09E +1 | -3.36E-2 | 1.60E-4 | -9.88E-8 | 3.197 | 9.093 | 740.92 | -1.713 |
| -COOH (asam) | 0.0791 | 0.0077 | 89 | 169.09 | 155.50 | -426.72 | -387.87 | 2.41E +1 | 4.27E-2 | 8.04E-5 | -6.87E-8 | 11.051 | 19.537 | 1317.23 | -2.578 |
| -COO-(ester) | 0.0481 | 0.0005 | 82 | 81.10 | 53.60 | -337.92 | -301.95 | 2.45E +1 | 4.02E-2 | 4.02E-5 | -4.52E-8 | 6.959 | 9.633 | 483.88 | -0.966 |
| = O (selain di atas) | 0.0143 | 0.0101 | 36 | -10.50 | 2.08 | -247.61 | -250.83 | 6.82 | 1.96E-2 | 1.27E-5 | -1.78E-8 | 3.624 | 5.909 | 675.24 | -1.340 |
| Nitrogen kelompok | |||||||||||||||
| -NH2 | 0.0243 | 0.0109 | 38 | 73.23 | 66.89 | -22.02 | 14.07 | 2.69E +1 | -4.12E-2 | 1.64E-4 | -9.76E-8 | 3.515 | 10.788 | n. a. | n. a. |
| > NH (non-cincin) | 0.0295 | 0.0077 | 35 | 50.17 | 52.66 | 53.47 | 89.39 | -1.21 | 7.62E-2 | -4.86E-5 | 1.05E-8 | 5.099 | 6.436 | n. a. | n. a. |
| > NH (cincin) | 0.0130 | 0.0114 | 29 | 52.82 | 101.51 | 31.65 | 75.61 | 1.18E +1 | -2.30E-2 | 1.07E-4 | -6.28E-8 | 7.490 | 6.930 | n. a. | n. a. |
| > N-(nonring) | 0.0169 | 0.0074 | 9 | 11.74 | 48.84 | 123.34 | 163.16 | -3.11E +1 | 2.27E-1 | -3.20E-4 | 1.46E-7 | 4.703 | 1.896 | n. a. | n. a. |
| -N = (nonring) | 0.0255 | -0.0099 | n. a. | 74.60 | n. a. | 23.61 | n. a. | n. a. | n. a. | n. a. | n. a. | n. a. | 3.335 | n. a. | n. a. |
| -N = (cincin) | 0.0085 | 0.0076 | 34 | 57.55 | 68.40 | 93.70 | 119.66 | 5.69 | -4.12E-3 | 1.28E-4 | -8.88E-8 | 3.649 | 6.528 | n. a. | n. a. |
| = NH | n. a. | n. a. | n. a. | 83.08 | 68.91 | 93.70 | 119.66 | 5.69 | -4.12E-3 | 1.28E-4 | -8.88E-8 | n. a. | 12.169 | n. a. | n. a. |
| CN- | 0.0496 | -0.0101 | 91 | 125.66 | 59.89 | 88.43 | 89.22 | 3.65E +1 | -7.33E-2 | 1.84E-4 | -1.03E-7 | 2.414 | 12.851 | n. a. | n. a. |
| -NO2 | 0.0437 | 0.0064 | 91 | 152.54 | 127.24 | -66.57 | -16.83 | 2.59E +1 | -3.74E-3 | 1.29E-4 | -8.88E-8 | 9.679 | 16.738 | n. a. | n. a. |
| Sulfur kelompok | |||||||||||||||
| -SH | 0.0031 | 0.0084 | 63 | 63.56 | 20.09 | -17.33 | -22.99 | 3.53E +1 | -7.58E-2 | 1.85E-4 | -1.03E-7 | 2.360 | 6.884 | n. a. | n. a. |
| -S-(nonring) | 0.0119 | 0.0049 | 54 | 68.78 | 34.40 | 41.87 | 33.12 | 1.96E +1 | -5.61E-3 | 4.02E-5 | -2.76E-8 | 4.130 | 6.817 | n. a. | n. a. |
| -S-(cincin) | 0.0019 | 0.0051 | 38 | 52.10 | 79.93 | 39.10 | 27.76 | 1.67E +1 | 4.81E-3 | 2.77E-5 | -2.11E-8 | 1.557 | 5.984 | n. a. | n. a. |
Contoh Perhitungan
Aseton (propanon) adalah yang paling sederhana keton dan dipisahkan menjadi tiga kelompok dalam metode Joback: dua kelompok metil (-CH3) dan satu kelompok keton (C = O). Karena gugus metil hadir dua kali, kontribusi yang harus ditambahkan dua kali.
| Properti | Jumlah kelompok | Kelompok nilai | Jumlah kelompok | Kelompok nilai |  | Perkiraan Nilai | Satuan |
| T c |
2
|
0.0141
|
1
|
0.0380
|
0.0662
|
500.5590
|
K
|
| P c |
2
|
-1.20E-03
|
1
|
3.10E-03
|
7.00E-04
|
48.0250
|
bar
|
| V c |
2
|
65.0000
|
1
|
62.0000
|
192.0000
|
209.5000
|
cm3/mol
|
| T b |
2
|
23.5800
|
1
|
76.7500
|
123.9100
|
322.1100
|
K
|
| T m |
2
|
-5.1000
|
1
|
61.2000
|
51.0000
|
173.5000
|
K
|
| Pembentukan H |
2
|
-76.4500
|
1
|
-133.2200
|
-286.1200
|
-217.8300
|
kJ / mol
|
| G pembentukan |
2
|
-43.9600
|
1
|
-120.5000
|
-208.4200
|
-154.5400
|
kJ / mol
|
| C pa |
2
|
1.95E +01
|
1
|
6.45E +00
|
4.55E +01
| ||
| C pb |
2
|
-8.08E-03
|
1
|
6.70E-02
|
5.08E-02
| ||
| C pc |
2
|
1.53E-04
|
1
|
-3.57E-05
|
2.70E-04
| ||
| C pd |
2
|
-9.67E-08
|
1
|
2.86E-09
|
-1.91E-07
| ||
| C p |
pada T = 300 K
|
75.3264
|
J / (mol * K)
| ||||
| H fusi |
2
|
0.9080
|
1
|
4.1890
|
6.0050
|
5.1250
|
kJ / mol
|
| H VAP |
2
|
2.3730
|
1
|
8.9720
|
13.7180
|
29.018
|
kJ / mol
|
| suatu η |
2
|
548.2900
|
1
|
340.3500
|
1436.9300
| ||
| η b |
2
|
-1.7190
|
1
|
-0.3500
|
-3.7880
| ||
| η |
pada T = 300 K
|
0.0002942
|
Pa s
| ||||
Blog Archive
-
▼
2011
-
▼
October
- Kekuatan/Gaya
- Berat badan Dari Wikipedia, ensiklopedia be...
- Microviscosity
- Bilangan Reynolds
- Kelekatan
- Metode Joback
- Prinsip Bernoulli
- Gaya hambat
- Persamaan Darcy-Weisbach
- Laminer dan Turbulen
- Bilangan Reynolds
- Aliran Laminer dan Turbulen
- Mekanika Fluida
- Mekanika statistika
- Massa jenis
- Tekanan Geser
- Fluida non-Newtonian
- Fluida Newtonian
- Fluida
- Drag (fisika)
- Hukum Stoke
- Mekanika fluida
- http://id.wikipedia.org/wiki/ Benzyl chloride ...
- http://en.wikipedia.org/wiki/Butane Butana Bu...
- Maaf temen2 aku Cuma dapat segini… contoh indus...
- Benzene
- 845024 Benzil Kloridauntuk sintesis farma, non-GM...
- I. Nama Molekul :...
-
▼
October


Post a Comment